استخدامات الكربون وخواصه الفيزيائية

ما هو الكربون
الكربون هو عنصر كيميائي مثل الهيدروجين والأكسجين والرصاص وأي عنصر آخر في الجدول الدوري، والكربون عنصر وفير جداً ويوجد بأشكال نقية مثل الماس والجرافيت ويمكن أيضًا أن يتحد مع عناصر أخرى لتشكيل الجزيئات، وهذه الجزيئات تكون قائمة على الكربون وعبارة عن اللبنات الأساسية للبشر والحيوانات والنباتات والأشجار والتربة، وبعض الغازات الدفيئة مثل ثاني أكسيد الكربون والميثان تتكون أيضًا من جزيئات قائمة على الكربون مثل الوقود الأحفوري الذي يتكون إلى حد كبير من الهيدروكربونات (جزيئات تتكون من الهيدروجين والكربون).
ويعتبر المصدر الرئيسي للكربون هو رواسب الفحم المدفونة في أعماق الأرض، وهناك ثلاثة تآصلات للكربون وهي الجرافيت والماس والكربون غير المتبلور، ويعتبر الكربون عنصرًا مستقرًا ويمكن أن يتحد مع أي عنصر آخر لتكوين عدد من المركبات المفيدة، ولذلك تم تخصيص الكيمياء العضوية وهي فرع من فروع الكيمياء لدراسة خصائص واستخدامات الكربون كعنصر كيميائي وفي أشكاله المركبة.

ذرة الكربون
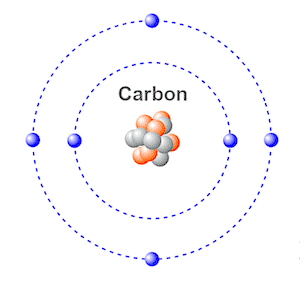
العدد الذري للكربون هو 6، وهو ما يمثل عدد الإلكترونات. ويرمز له بالرمز C وهو مادة غير معدنية. لديها 6 بروتونات و 6 نيوترونات ومن الواضح أن 6 إلكترونات. تعتبر ذرة الكربون مميزة وفريدة من نوعها لأنها يمكن أن ترتبط مع ذرات الكربون الأخرى بدرجة غير محدودة تقريبًا. وذلك لأن ذرته صغيرة جدًا في الحجم ويمكن أن تتناسب بسهولة كجزء من جزيئات أكبر. تحتوي كل ذرة من ذراته على أربعة إلكترونات في غلافها الخارجي تسمى إلكترونات التكافؤ ويمكن أن تشكل روابط كيميائية مع الذرات والجزيئات الأخرى.
الخصائص الفيزيائية للكربون
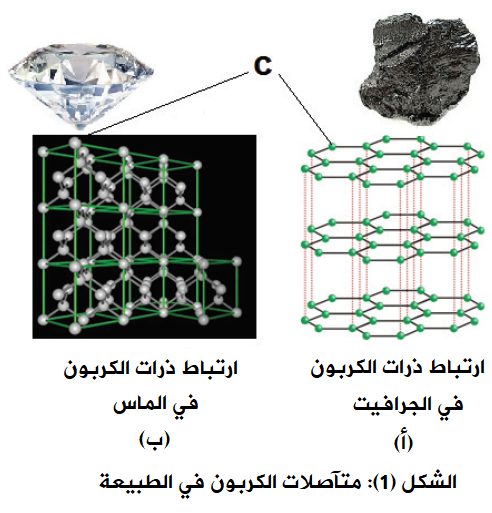
يمتلك الكربون نقطة انصهار تبلغ 3652 درجة مئوية ونقطة غليان تبلغ 4827 درجة مئوية، لذلك فهو موجود دائمًا كمادة صلبة. وهي ناعمة ورمادية أو سوداء باهتة. بعض خصائصه الفيزيائية تعتمد على المتآصلة. المتآصل هو نسخة من عنصر له بنية فيزيائية مختلفة. تختلف روابط الذرات داخل الجزيء، مما يؤدي إلى اختلاف الخصائص الفيزيائية. اثنان من أكثر متآصلات الكربون شيوعًا هما الجرافيت والماس.
- الجرافيت مادة ناعمة وخفيفة وموصلة جيدة للحرارة والكهرباء. كثافته 2.26 جم/سم 3 . أما الماس، من ناحية أخرى، فهو صلب وقوي وموصل رديء للكهرباء (لكنه موصل جيد للحرارة). كثافته 3.51 جم/سم 3 .
- إنهم ليسوا مختلفين جسديًا فحسب ، بل كيميائيًا أيضًا. يمكن أن يتفاعل الجرافيت بعنف مع العوامل المؤكسدة القوية مثل الفلور، كما أن غبار الجرافيت والهواء ينفجران عند اشتعالهما. لا يتفاعل الألماس على الإطلاق في درجة حرارة الغرفة، لكنه يمكن أن يشتعل عند درجة حرارة 690 درجة مئوية تقريبًا إذا تم وضعه في بيئة تحتوي على أكسجين نقي.
- الآن، لا يمكن للماس أن يوصل الكهرباء على الإطلاق، والجرافيت موصل جيد جدًا للكهرباء
- كلا العنصرين المتآصلين صلبان وغير غازيين
- كما أن كلا من الماس والجرافيت غير قابلين للذوبان في الماء
- لا يذوب عند تسخينه، بل يتسامى ويتحول إلى الحالة الغازية
استخدامات الجرافيت بالصناعة
ينتج الجرافيت أحد أشكال الكربون من تعرض مكوناته لدرجات حرارة عالية وضغط عند تكونه، ويسمى أيضًا بالكربون البلوري، ومن أهم خصائصه سهولة استعماله وتشكيله في الصناعات، ويتميز بموصليته الجيدة للحرارة والكهرباء، ويعتبر من المعادن غير النشطة كيميائيًا خلال التفاعلات الكيميائية، ومن أهم استعمالاته الصناعية:
صناعة الأقطاب الكهربائية
يدخل الجرافيت في صناعة الأقطاب الكهربائية في البطاريات وأقطاب الخلايا الكهروكيميائية وصناعة بطاريات الليثيوم القابلة لإعادة الشحن، كما يستعمل في المفاعلات النووية كمادة مثبتة تساعد على الحد من حركة النيوترونات خلال التفاعلات النووية.
استخدام الماس في الصناعة
يعتبر معدن الماس أحد الأشكال الكربونية المتوفرة في الطبيعة، ولا يقتصر استعماله على صناعة المجوهرات فقط إذ يمكن الاعتماد عليه في الأغراض الصناعية لتمتعه بالصلابة والقوة والقدرة على تحمل الضغط بسبب الروابط الكيميائية القوية بين ذرات الكربون، ومن خصائصه أيضًا موصليته الجيدة للحرارة ومقاومته للعوامل الكيميائية، ومن أهم استعمالاته الصناعية:
صناعة الأجهزة
يدخل الماس في صناعة بعض أجزاء الأجهزة كالموجودة في أجهزة التصوير بالأشعة السينية، وأجهزة الليزر، لما يتمتع به من خصائص كمقاومته للتلف والتآكل وموصليته للطاقة الحرارية ومتانته.
استخدامات الكربون
الكربون لديه الكثير من الاستخدامات. فيما يلي جزء صغير من استخداماته:
- 1-المستخدمة في الوقود الأحفوري (الهيدروكربونات).
- 2-يستخدم في أقلام الرصاص (الجرافيت).
- 3-يستخدم في المجوهرات (الماس).
- 4-تستنشقه النباتات وتحوله إلى أكسجين (عملية البناء الضوئي) (CO 2 ).
- 5-تستخدم في المواد ذات قوة الشد العالية (الفوليرين/كرة الباكي).
- 6- 12% من جسم الإنسان (عنصر الكربون).
- 7-أحد أهم الاستخدامات هو التأريخ بالكربون. يمكننا في الواقع استخدام الكربون لقياس عمر الأشياء. يستخدم العلماء شكلاً نادرًا من الكربون يسمى الكربون 14 لقياس عمر الحفريات والعظام وما إلى ذلك. ويتم تسجيل إطلاق هذا الكربون 14 لتقدير عمر المادة العضوية المذكورة. هكذا يجد العلماء عمر وفترة عظام وحفريات الديناصورات!.
استخدامات الكربون في الطب
طور خبراء الصحة الكربون لتطوير علاجاتهم الطبية لأمراض معينة حيث يمكن أن يمتص الكربون المواد الخطرة مثل السموم والغازات السامة في الجهاز الهضمي، على الرغم من أن الكربون يشكل 18٪ فقط من كتلة الجسم إلا أنه مهم في تكوين البروتينات والكربوهيدرات والدهون، الكربون ضروري في التنفس الخلوي لإنتاج الطاقة للأنشطة البشرية، ويمكن أن ينقذ الفحم المنشط حياة شخص ما لأن الأطباء يستخدمونه لعلاج حالات التسمم الكيميائي والجرعات الزائدة من الأدوية.
الكربونية مهمة في الصناعات الطبية والبصرية نظرًا لما تتمتع به من توصيل حراري استثنائي وخصائص كيميائية وفيزيائية أخرى، يحاول العلماء استخدام الأنابيب النانوية الكربونية في مراقبة الصحة والطرق المختلفة لعلاج الأمراض، حيث تتمتع الأنابيب النانوية الكربونية بإمكانية استخدامها كوسيلة لنقل الأدوية في جسم الإنسان، ولذلك يكون من المتوقع أن تعزز الأنابيب النانوية كفاءة توصيل الأدوية في حالات الأورام والسرطان.
هناك الكثير من الاستخدامات، ولكن هذه تعطيك نظرة جيدة على مدى انتشار الكربون. لا يسمونها لبنة الحياة من أجل لا شيء!
المصادر:
1-https://www.studysmarter.co.uk/explanations/chemistry/organic-chemistry/carbon
2-https://www.toppr.com/guides/chemistry/carbon-and-its-compounds/carbon/
3-https://www.britannica.com/science/rhodium
4-https://www.almrsal.com/post/1139301